מאת: ד”ר נעה מור PharmD ודותן שניו
(תודה מיוחדת לפרופ’ אילן יונגסטר שקרא את טיוטת הפוסט טרם פרסומו)
הקדמה
עקה חמצונית (Oxidative stress) היא מצב במערכת ביולוגית שבו מופר האיזון בין ייצור של רדיקלים חופשיים (Reactive Oxygen Species, ROS) לבין יכולתה של המערכת לנטרלם (בדרך כלל באמצעות חומרים מחזרים הידועים בכינוי ‘נוגדי חמצון’). משמעות הדבר היא הצטברות של חומרים מחמצנים שיכולים לגרום נזק לתאים ורקמות.
רדיקלים חופשיים נוצרים בתא במסלולים אנזימטיים ולא-אנזימטיים, כגון תהליך הנשימה התאית במיטוכונדריה (איור 1) וחשיפה לקרינה מייננת (איור 2), בהתאמה.

SOD = superoxide dismutase, CAT = catalase, GPx = glutathione peroxidase. (מקור: Bhatti, Bhatti & Reddy, 2017)

חשוב לציין שלרדיקלים חופשיים ישנם מספר תפקידים פיזיולוגיים בגוף האדם. פאגוציטים, למשל, מייצרים ומאחסנים רדיקלים חופשיים במטרה לפגוע במיקרובים פתוגניים ולנטרלם. בנוסף, רדיקלים חופשיים מעורבים במסלולי איתות תאיים בתאים שונים, כגון פיברובלסטים, תאי אנדותל, תאי שריר הלב ובלוטת התריס. רדיקל חופשי מוכר הוא Nitric Oxide (NO), אשר אחת מפעולותיו היא הרפיית שריר חלק המקיף כלי דם והורדת לחץ דם, אולם יש לו תפקידים רבים נוספים בגוף האדם – על חלקם ניתן לקרוא במאמר של (Rosselli et al. (1998 (ר’ רשימת מקורות).
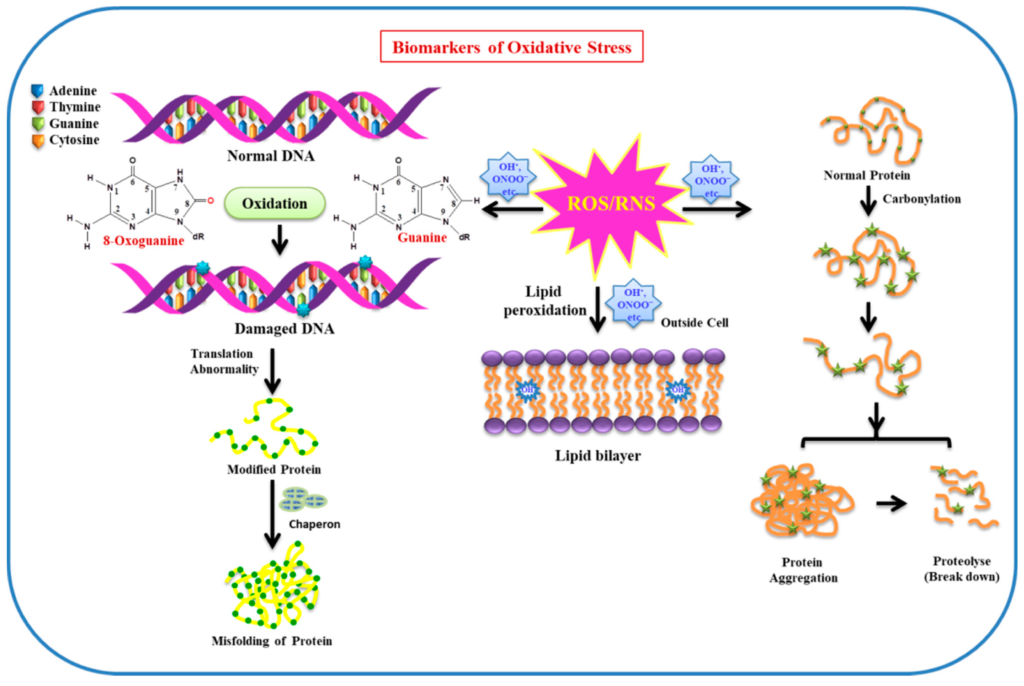
מנגד, כאמור לעיל, ריכוזים גבוהים של רדיקלים חופשיים גורמים לעקה חמצונית, שבמסגרתה חלקים בתא עלולים להתחמצן ולהיפגע (איור 3). לדוגמא, חמצון של ליפידים עלול לפגוע בממברנות התא ובתפקודם של ליפופרוטאינים, חמצון של חלבונים עלול לגרום לשינויי קונפורמציה ולאובדן פעילות אנזימטית, וחמצון של DNA בגרעין התא הינו תהליך מוטגני, קרי, עלול לגרום לשינויים ב-DNA וליצירת מוטציות.
כוחם ההרסני של הרדיקלים החופשיים נובע משתי סיבות:
- מדובר בחומרים ריאקטיביים מאוד, מכיוון שיש להם אלקטרון אחד בלתי-מזווג בקליפה החיצונית של המולקולה. מצב זה אינו יציב מבחינה תרמודינמית ומוביל ל”רצון” עז לחטוף אלקטרון כדי להשלים את מניין האלקטרונים בקליפה החיצונית ולהגיע למצב יציב.
- רדיקלים חופשיים לרוב מציתים תגובת שרשרת, מכיוון שנטילה של אלקטרון בודד מחומר יציב כלשהו (כגון חומצת שומן) מותירה אותו עם אלקטרון בלתי-מזווג בודד, מה שהופך אותו לרדיקל חופשי בעצמו, שבתורו יחטוף אלקטרון מחומר אחר, וחוזר חלילה. באופן זה, אלמנטים רבים בתא עלולים להיהרס בזה אחר זה.
ניטרול של רדיקלים חופשיים מתבצע על ידי חומרים נוגדי חמצון, שהינו שם כולל לחומרים עשירים באלקטרונים, אשר מסוגלים לתרום אלקטרון בודד ולהישאר יציבים (איור 4). במולקולות שנחשבות נוגדות חמצון, האלקטרונים מסודרים בצורה כזו שהמולקולה נותרת יציבה גם לאחר איבוד של אלקטרון בודד לטובת מולקולה של רדיקל חופשי. באופן זה, נוגדי חמצון מסוגלים לעצור את תגובת השרשרת ההרסנית של הרדיקלים החופשיים.

בין נוגדי החמצון האקסוגניים המוכרים ביותר נמצאים ויטמינים ופיגמנטים שונים, כגון ויטמין C, ויטמין E, בטא-קרוטן, ליקופן, ועוד (ניתן למצוא רשימות של נוגדי חמצון באתרים שונים, כגון DrugBank וויקיפדיה). קיימים בגוף האדם גם נוגדי חמצון אנדוגניים, שאחד המוכרים והחשובים שבהם הוא (![]() ) Nicotinamide Adenine Dinucleotide Phosphate, אשר משמש כנשא אלקטרונים בתא ומסוגל להתחמצן (
) Nicotinamide Adenine Dinucleotide Phosphate, אשר משמש כנשא אלקטרונים בתא ומסוגל להתחמצן (![]() ) ולהתחזר (
) ולהתחזר (![]() ) על מנת לסייע לתהליכים שונים בתא שתלויים במעבר אלקטרונים בין חומרים, כגון ייצור של נוקלאוטידים, חומצות שומן וסטרואידים, ובנוסף יש לו תפקיד חשוב בפעילות של אנזימי ציטוכרום P450 שאחראי למטבוליזם של תרופות רבות וחומרים קסנוביוטים נוספים. להרחבה על תפקידי NADPH והביוכימיה שלו, ניתן לעיין כאן.
) על מנת לסייע לתהליכים שונים בתא שתלויים במעבר אלקטרונים בין חומרים, כגון ייצור של נוקלאוטידים, חומצות שומן וסטרואידים, ובנוסף יש לו תפקיד חשוב בפעילות של אנזימי ציטוכרום P450 שאחראי למטבוליזם של תרופות רבות וחומרים קסנוביוטים נוספים. להרחבה על תפקידי NADPH והביוכימיה שלו, ניתן לעיין כאן.
הביוכימיה של Glucose 6-phosphate dehydrogenase (G6PD)
בשנת 1932 שני חוקרים גרמניים (Warburg ו-Christian) זיהו בשמרים ובתאי דם אדומים תהליך אנזימטי שמסייע במטבוליזם של פחמימות ע”י חמצון של Glucose-6-Phosphate ל-6-Phosphogluconolactone. בתהליך החמצון לא משתתפות מולקולות חמצן, אלא הוא מתבצע על ידי אנזים, שבתחילה כונה Zwischenferment (“אנזים ביניים” בגרמנית) ולימים נקרא Glucose 6-phosphate dehydrogenase (G6PD), באמצעות חיזור של NAD phosphate (NADP) ל-NADPH (איור 5).
תזכורת מכימיה אורגנית: תהליכי חמצון-חיזור הם תהליכים משלימים, שבמסגרתם חומר אחד (המחמצן) מתחזר (מקבל אלקטרונים/אטומי מימן) וחומר שני (המחזר) מתחמצן (מאבד אלקטרונים/אטומי מימן). באיור 5, Glucose-6-phosphate הוא המחזר (ובעצמו מתחמצן, מאבד מימנים) ו-NADP הוא המחמצן (ובעצמו מתחזר, מקבל מימנים).
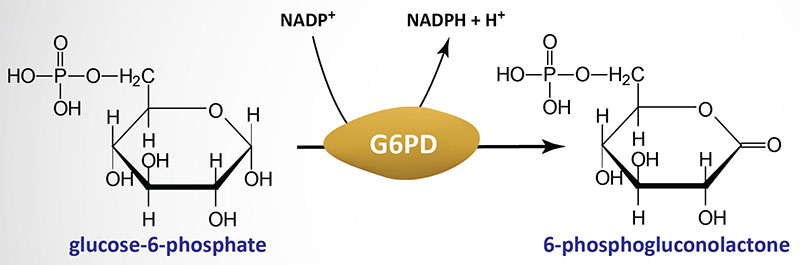
מקור: The Medical Biochemistry Page
פעילותו של G6PD הינה חלק מתהליך ביוכימי גדול יותר שמתרחש בכל תאי הגוף ונקרא ‘מסלול הפנטוז פוספאט’ (Pentose Phosphate Pathway, PPP). ניתן להתרשם ממנו באיור 6. כאשר מולקולת גלוקוז נכנסת לתא (1), היא הופכת בתהליך אנזימטי ל-Glucose-6-phosphate (2), ואז נכנסת לאחד משני תהליכים: גליקוליזה (3), המיועדת להפקת אנרגיה בצורת ATP עבור צרכי התא, או מסלול הפנטוז פוספאט (4), אשר התוצר הסופי שלו הוא המולקולה Ribose-5-phosphate (5), שמהווה אבן בניין לנוקלאוטידים, רב-סוכרים וקואנזימים שונים. חשוב לציין שבשני שלבים שונים במסלול זה (6, 7) נוצרות מולקולות NADPH: על ידי האנזים G6PD ועל ידי האנזים ![]() .
.
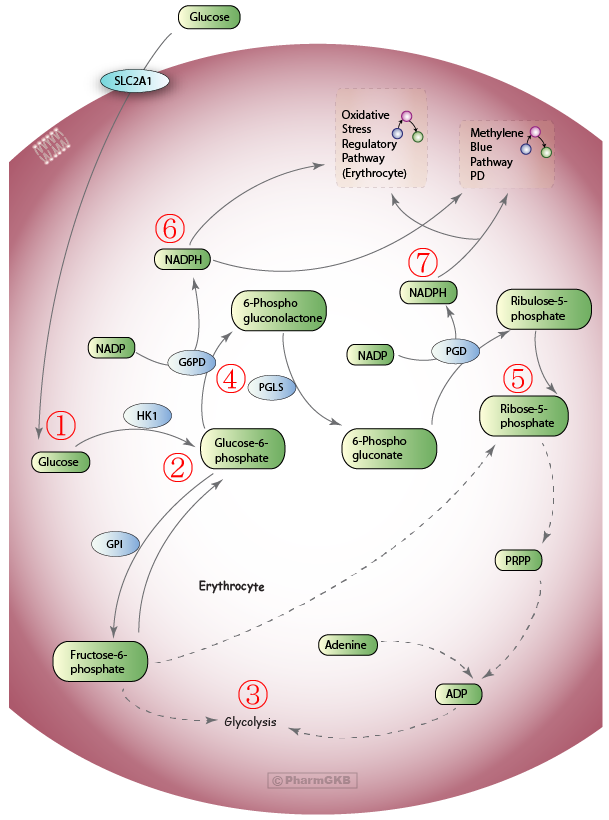
השלב הראשון במסלול הפנטוז פוספאט הוא התהליך המתואר באיור 5 – חמצון של Glucose-6-Phosphate ל-6-Phosphogluconolactone על ידי האנזים G6PD, בהשתתפות ![]() שמתחזר ל-
שמתחזר ל-![]() . במקרה שהאנזים חסר בתא, מסלול הפנטוז פוספאט מעוכב באופן משמעותי, ונוצרות הרבה פחות מולקולות של NADPH. במצב זה, חשיפה לתרופות מסויימות (כפי שיפורט להלן) או לפול (fava beans) גורמת לכך שתאי הדם האדומים אינם מסוגלים להתמודד עם היווצרות הרדיקלים החופשיים ועוברים פירוק (המוליזה), אשר גורם בין היתר לירידה חדה בהמוגלובין. מצב זה נקרא ‘אנמיה המוליטית‘ והוא עלול להיות מסכן חיים ואף להצריך מתן מנות דם (ר’ סיכום תיאורי מקרה בהמשך).
. במקרה שהאנזים חסר בתא, מסלול הפנטוז פוספאט מעוכב באופן משמעותי, ונוצרות הרבה פחות מולקולות של NADPH. במצב זה, חשיפה לתרופות מסויימות (כפי שיפורט להלן) או לפול (fava beans) גורמת לכך שתאי הדם האדומים אינם מסוגלים להתמודד עם היווצרות הרדיקלים החופשיים ועוברים פירוק (המוליזה), אשר גורם בין היתר לירידה חדה בהמוגלובין. מצב זה נקרא ‘אנמיה המוליטית‘ והוא עלול להיות מסכן חיים ואף להצריך מתן מנות דם (ר’ סיכום תיאורי מקרה בהמשך).
ציוני דרך במחקר על חסר ב-G6PD ונתונים אפידמיולוגיים
בשנות ה-50 של המאה ה-20 התגלו כמה עובדות קריטיות להבנת פעילות ותפקיד האנזים G6PD בגוף האדם:
- בשנת 1956 מדענים מאוניברסיטת שיקגו (Carson et al.) מצאו שגברים שפיתחו אנמיה המוליטית חריפה לאחר נטילת Primaquine (תרופה נוגדת מלריה) היו חסרי האנזים G6PD בתאי דם אדומים.
- ב-1958 מדענים איטלקיים (Sansone ו-Segni) הוכיחו שבמטופלים עם Favism (שם ישן למצב של חסר ב-G6PD שמקורו בתגובה הטיפוסית בחולים אלו לאכילת fava beans) יש חסר באנזים G6PD.
- במקביל, ב-1958 הרופאים הישראליים פרופ’ אריה שיינברג (Szeinberg) ופרופ’ חיים שיבא (Sheba) מצאו שהגן האחראי לביטוי של G6PD מצוי על גבי כרומוזום X.
ממצא זה הוא הבסיס לכך שגברים, שהינם בעלי כרומוזום X אחד (XY), הם בעלי סיכון משמעותי לסבול מחסר באנזים עם משמעות קלינית עקב מוטציה בגן זה בהשוואה לנשים (XX), שנדרשות להיות הומוזיגוטיות (תורשה של המוטציה בגן גם מהאם וגם מהאב) לחסר באנזים בכדי להיות בסיכון מהותי מבחינה קלינית (איור 7).
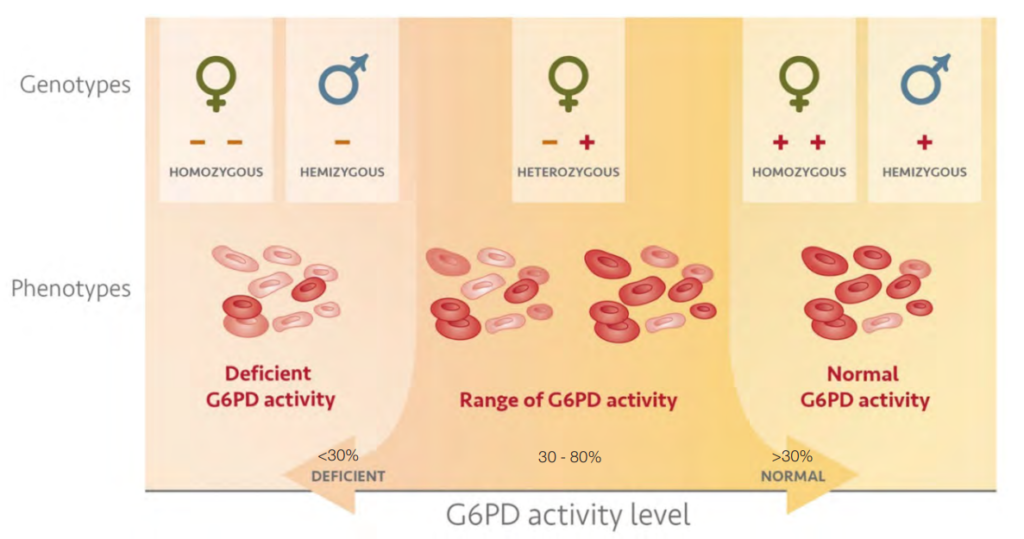
מקור: How to use a G6PD rapid diagnostic test / WHO
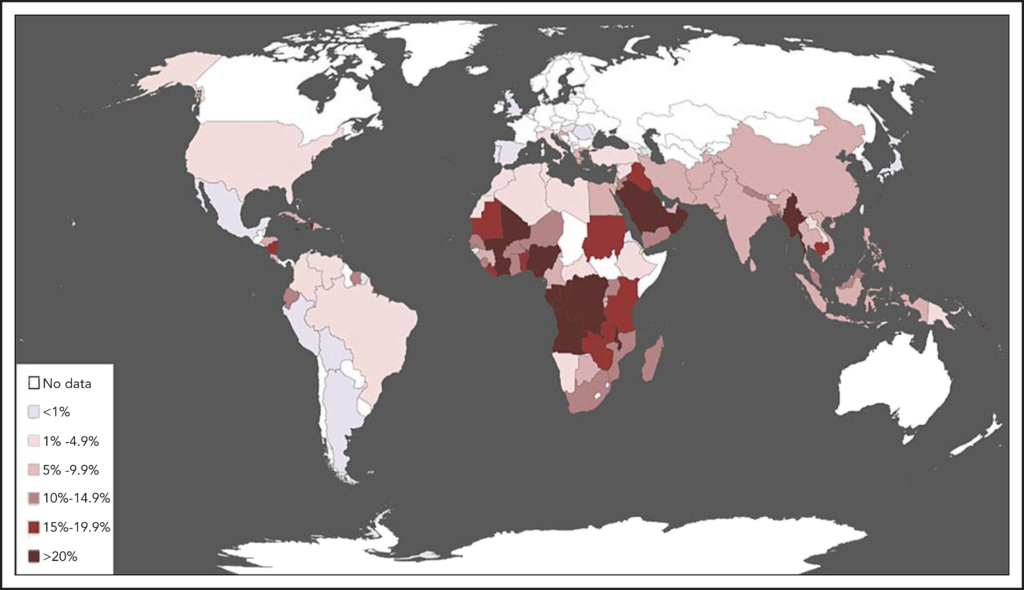
באופן היסטורי, חסר באנזים G6PD היה נפוץ באזורים גיאוגרפיים עם אוכלוסייה שנחשפה למלריה אנדמית, לרבות אפריקה, אגן הים-התיכון, דרום מזרח אסיה ואמריקה הלטינית (איור 8). הסברה היא שכאשר תאי דם אדומים חסרי האנזים G6PD נדבקים ב-Plasmodium falciparum (הטפיל מחולל המלריה), תאים מקרופאגים במערכת החיסון חשים אותם בשלב מוקדם וממגרים אותם. בשל כך, ייתכן שחסר ב-G6PD מעניק יתרון הישרדותי ממלריה באוכלוסייה זו. שכיחות המלריה באזורים אלו מציבה קושי רב במתן טיפול תרופתי ב-Primaquine שעלולה לגרום להמוליזה.
מכיוון שהאבולוציה אינה מתקדמת מהר כמו ההגירה, במדינות מערביות האוכלוסיות הסובלות מחוסר באנזים G6PD הן בעיקרן יוצאי האזורים הנ”ל. בישראל, יהודים יוצאי כורדיסטן, עירק ואיראן הינם בעלי סיכון גבוה משאר האוכלוסייה לחסר באנזים G6PD. מחקר מ-1976 שבחן את שכיחות החסר ב-10,668 ילודים בישראל מצא כי שכיחות חסר ב-G6PD בבנים יהודים מכורדיסטן הוא 50%, מעיראק 25% ומאיראן 13%. בבנות נצפתה התופעה רק אצל בנות שמוצאן מעיראק (6.5%) ומאיראן (7.5%), שחלקן היו הטרוזיגוטיות לחוסר באנזים.
חשוב לציין כי חסר ב-G6PD אין משמעותו שהאנזים אינו קיים כלל בתאי הגוף. ישנם מספר וריאנטים למוטציות הגורמות לחסר באנזים G6PD, הנבדלים בין היתר באחוז פעילות האנזים לעומת אדם עם תאי דם אדומים תקינים. הווריאנט A- נפוץ יותר בקבוצות אוכלוסיה מאפריקה ומתאפיין בפעילות אנזים המוערכת ב-10-23% מפעילות האנזים בתא דם אדום תקין. הווריאנט הנפוץ בישראל הוא הווריאנט הים-תיכוני (G6PD Mediterranean הנפוץ ביהודים מכורדיסטן, עיראק ואיראן כפי שצויין לעיל), אשר מתאפיין בפחות מ-5% מהפעילות התקינה של האנזים ולכן וריאנט זה מקושר במידה רבה ל-Favism ולאנמיה המוליטית חריפה על רקע שימוש בתרופות מסויימות.
האם חסר ב-G6PD פוגע רק בתאי הדם האדומים?
חשוב לציין שחסר ב-G6PD מוזכר בעיקר בהקשר של תאי הדם האדומים, אולם האנזים קיים בכל תאי הגוף, ולכן באנשים עם חסר באנזים, החסר מופיע בכל התאים בגוף. מדוע בכל זאת עיקר ההתייחסות היא לתאי הדם האדומים בהקשר של חסר ב-G6PD?
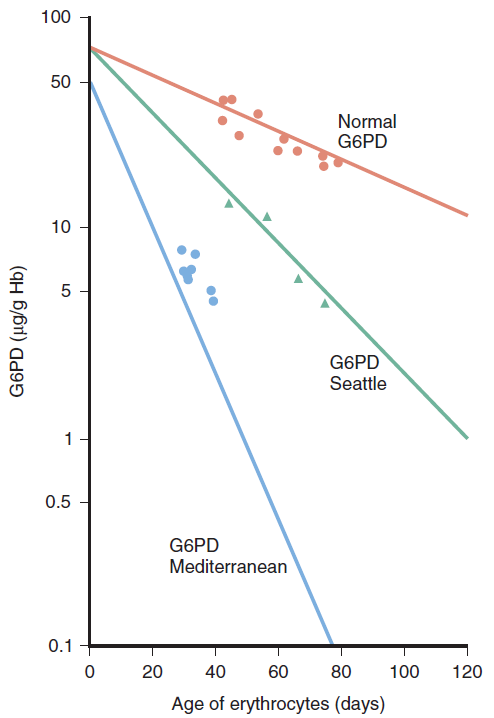
- באנשים עם הווריאנט הים-תיכוני, פעילות האנזים בתאי הדם האדומים היא פחות מ-5% לעומת אנשים עם אנזים תקין, אולם בגרנולוציטים פעילות האנזים היא כ-30% לעומת אנזים תקין. באנשים עם וריאנט A-, פעילות האנזים בתאי הדם האדומים היא כ-12% לעומת אנשים עם אנזים תקין, אולם בגרנולוציטים פעילות האנזים היא כמעט מלאה. החסר בתאי הדם האדומים הוא הרבה יותר משמעותי לעומת תאים אחרים בגוף.
- תאי דם אדומים בוגרים הינם חסרי גרעין, ולכן אינם יכולים לייצר חלבונים חדשים לעומת תאים סומטיים אחרים. לפיכך, אנזימים שנהרסים בתא הדם האדום לא יוחלפו בחדשים. זמן מחצית החיים של אנזים תקין הוא כ-60 ימים, זמן מחצית החיים של אנזים לא תקין הרבה יותר קצר (ר’ איור 9).
- תאי דם אדומים הרבה יותר חשופים לרדיקלים חופשיים בשל קרבתם הרבה למולקולות חמצן, ולכן פעילות האנזים בהם לטובת ייצור NADPH, המאפשר לנטרל את אותם רדיקלים חופשיים, משמעותית הרבה יותר מאשר בתאי הגוף האחרים.
תרופות אסורות לשימוש בקרב אנשים עם חסר ב-G6PD
בשנת 2010, קבוצת חוקרים מבתי החולים יצחק שמיר (לשעבר אסף הרופא) וקפלן (Youngster et al.) פרסמה סקירת ספרות שיטתית שעסקה בתרופות וחסר באנזים G6PD. המוטיבציה לביצוע הסקירה הייתה העדר מקור מידע יחיד מקובל בנוגע לתרופות אסורות בשימוש בחולים עם חסר ב-G6PD. בשיטות המחקר מתואר חיפוש במקורות האלקטרוניים MEDLINE (בשנים 1966-2009), PUBMED (בשנים 1950-2009), Cochrane database of systematic reviews וכן בספרים בתחומי הפרמקולוגיה, רפואה פנימית, המטולוגיה ורפואת ילדים. החוקרים חילקו את התרופות שנסקרו לשלוש קטגוריות:
- תרופות מהן יש להימנע באנשים שסובלים מחסר באנזים G6PD
- תרופות שנחשבות לא בטוחות לשימוש לפחות על פי מקור מידע אחד, אך סביר שיכולות להינתן באופן בטוח במינונים הסטנדרטיים
- תרופות שעבורן אין עדות שמצריכה את הגבלת השימוש בהן באנשים עם חוסר באנזים G6PD.
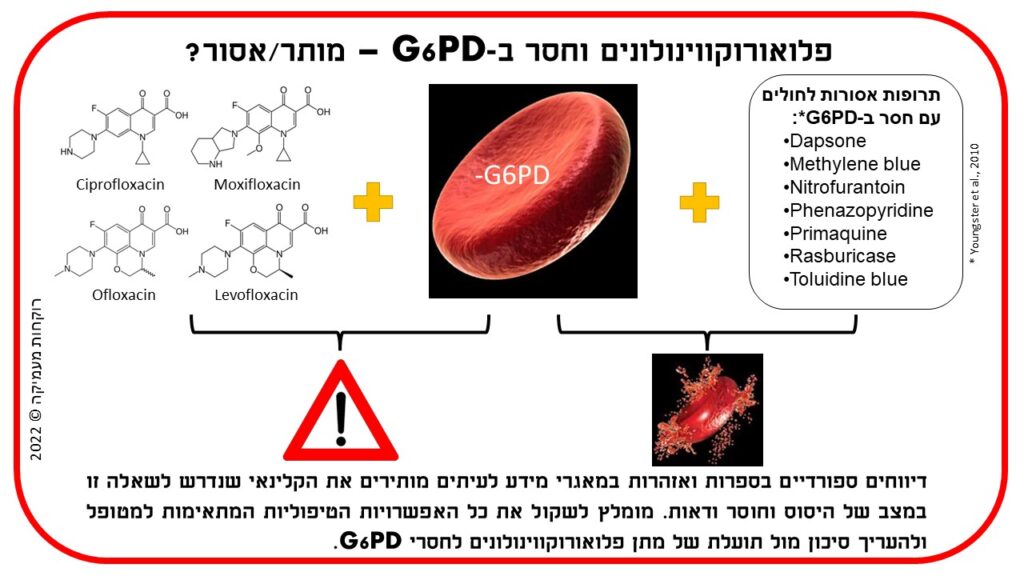
הממצא המרכזי בסקירה זו הוא הקבוצה הראשונה – רשימת התרופות שמהן יש להימנע באנשים שסובלים מחוסר ב-G6PD. תרופות אלו הן:
- Dapsone – תרופה אנטימיקרוביאלית לטיפול בצרעת
- Methylene blue – תרופה לטיפול במתהמוגלובינמיה
- Nitrofurantoin – תרופה אנטיביוטית לטיפול בדלקות בדרכי השתן
- Phenazopyridine – משכך כאבים להקלה סימפטומטית על כאבים בעת מתן שתן
- Primaquine – תרופה אנטי-טפילית למניעה ולטיפול במלריה
- Rasburicase – תרופה לטיפול בהיפראוריצמיה על רקע ממאירות
- Toluidine blue – חומר המשמש לאבחון של ממאירויות בפה ובבלוטת התריס
מעניין לציין כי הספר Nathan and Oski’s Hematology and Oncology of Infancy and Childhood (8th ed., 2015), אשר מקדיש את פרק 18 לחסר ב-G6PD, מציג את הטבלה הבאה:
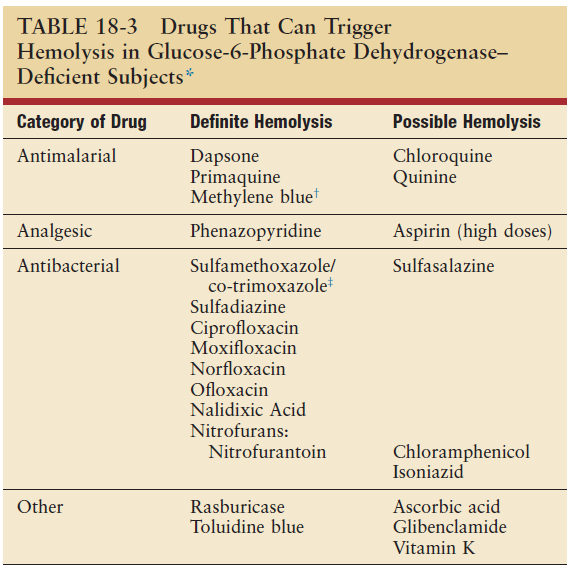
בהערה לטבלה מציינים המחברים כי עדכון הטבלה ממהדורות קודמות של הספר נעשה לאור סקירתם של Youngster et al. אולם הם מסבירים את ההבדלים בין הטבלה שלהם לבין הסקירה בכך שלשיטתם לא ניתן להשתמש בקונספט של רמות ראיות (levels of evidence), המשמש להערכת יעילות של תרופות, לצורך הערכת בטיחות של תרופות באותו אופן. לפיכך, המחברים טוענים כי יש לקחת בחשבון גם תיאורי מקרה בודדים המתועדים בצורה משכנעת, ומכאן נובעים ההבדלים בין הטבלה הנ”ל לבין הסקירה.
בהתייחס לפלואורוקווינולונים (Ciprofloxacin, Levofloxacin ו-Ofloxacin) לא נמצאו במסגרת סקירת הספרות דיווחים על המוליזה במטופלים חסרי האנזים G6PD שנטלו פלואורוקווינולונים. עם זאת, דווחו מספר מקרי המוליזה לאחר שימוש בקווינולונים, ללא קשר לחסר ב-G6PD. החוקרים מסכמים שהאזהרה הקיימת בעלוני התרופות (ר’ להלן בכחול) נרשמה על סמך אזהרה דומה הקיימת עבור Nalidixic acid (שלוש התרופות הנ”ל הן נגזרות שלה, ר’ איור 10), ולא נתמכת בספרות עדכנית. מסקנתם הייתה שאין ראיות שבגינן יש למנוע את השימוש בפלואורוקווינולונים במינונים טיפוליים באנשים חסרי G6PD.
בעלון לרופא של Giroflox (Ciprofloxacin solution for infusion) אשר כלול במאגר התרופות של משרד הבריאות בישראל, קיימת התייחסות לטיפול בתרופה באנשים עם חסר ב-G6PD תחת סעיף אזהרות. לשון העלון בתרגום חופשי: “תגובות המוליטיות דווחו עם Ciprofloxacin במטופלים עם חסר ב-G6PD. יש להימנע מ-Ciprofloxacin במטופלים אלו, אלא אם התועלת הפוטנציאלית עולה על הסיכון האפשרי. במקרה שכזה, יש לעקוב אחר האפשרות להתרחשות של המוליזה.” דהיינו, העלון אינו מגביל את צוות הטיפול בבחירת הטיפול התרופתי, אולם מעלה את הצורך בניטור במידה והוחלט לתת את התרופה.
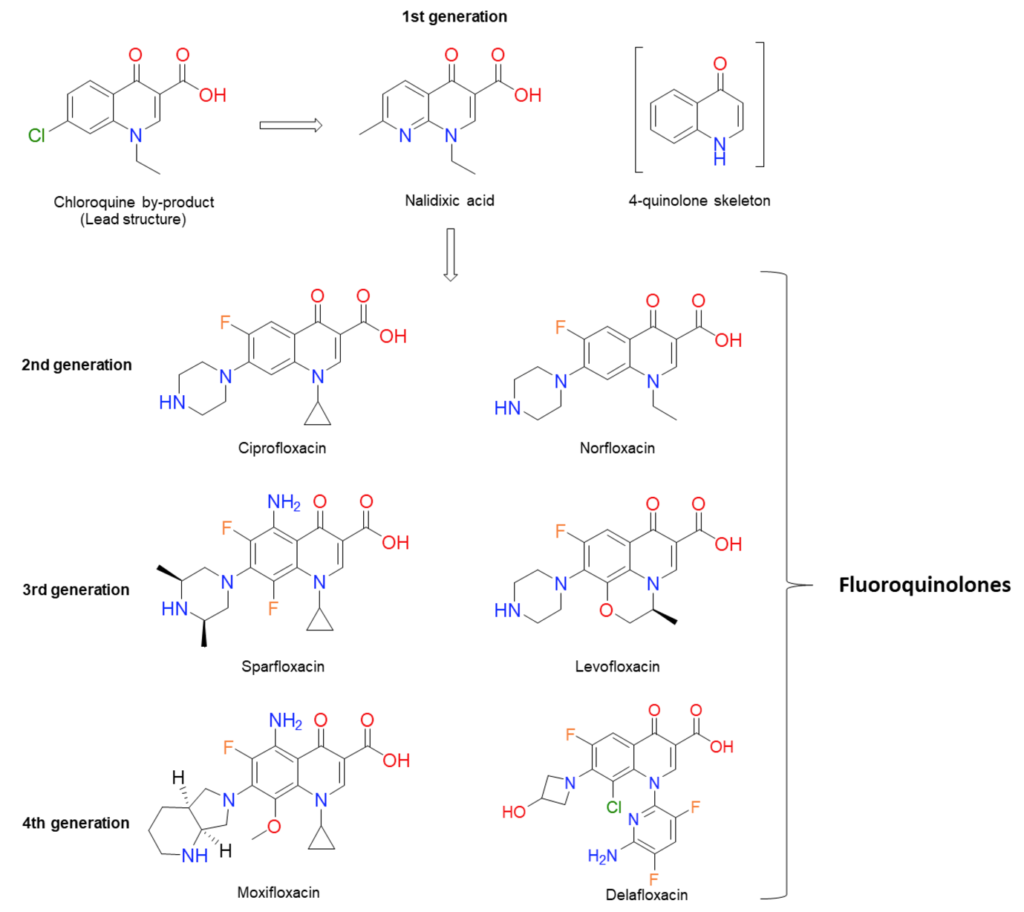
ב-2011 ההסתדרות הרפואית בישראל (הר”י) פרסמה את נייר העמדה “הנחיות קליניות מעודכנות לטיפול תרופתי באנשים חסרי האנזים G6PD” שגובש ע”י האיגוד הישראלי לרפואת ילדים והאיגוד הישראלי לפרמקולוגיה קלינית. נייר העמדה נסמך על הסקירה הנ”ל שפורסמה שנה קודם לכן, וכל ההמלצות המופיעות בו זהות למסקנות החוקרים. אף על פי כן, בבחינת מאגרי מידע שלישוניים פלואורוקווינולונים נותרו ברשימת התרופות שאינן בטוחות לשימוש בחסרי G6PD. הפלואורוקווינולונים הנחשבים ללא בטוחים ומשווקים בישראל הם Ciprofloxacin, Moxifloxacin, Ofloxacin, ללא התייחסות ל-Levofloxacin. מאמר סקירה עדכני מ-2020 מאת Luzzatto et al. מתמיד בהתייחסות לפלואורוקווינולונים כבעלי סיכון ודאי להמוליזה באנשים עם חוסר באנזים G6PD (טבלה 1 במאמר).
העשור שחלף מפרסום נייר העמדה על ידי הר”י והמלצות מאגרי המידע השלישוניים הציתו בפברואר 2022 סקירה מחודשת של נושא מתן פלואורוקווינולונים לחסרי G6PD. החיפוש לא נעשה בתנאי מחקר ועל כן אינו נחשב שיטתי, אולם ניתן להניח כי הוא מייצג נאמנה את מיעוט הדיווחים שמפורסמים בספרות בנושא זה ונותן תמונת מצב עדכנית בנוגע לקבוצת התרופות הספציפית. החיפוש בוצע במאגרים PUBMED, EMBASE, SCOPUS ו-GOOGLE SCHOLAR באמצעות שילוב מילות החיפוש G6PD, Hemolysis והשמות הגנריים של הפלואורוקווינולונים Ciprofloxacin, Moxifloxacin, Ofloxacin ו-Levofloxacin. אותרו 4 דיווחים שהתייחסו ל-Ciprofloxacin (ר’ פירוט להלן), דיווח אחד שהתייחס ל-Levofloxacin (ר’ Salehifar et al., 2021 ברשימת המקורות) ודיווח נוסף על Ofloxacin (ר’ Carmoi et al., 2009 ברשימת המקורות). לא נמצאו דיווחים על Moxifloxacin בהקשר זה. בבחינת הקשר בין אנטיביוטיקה לאנמיה המוליטית באנשים חסרי האנזים, יש לציין שזיהומים כשלעצמם יכולים לגרום לעקה חמצונית והמוליזה, כפי שציינו Youngster et al. בסקירתם.
ממצאי סקירת הספרות העדכנית בנוגע לטיפול בפלואורוקווינולונים בחסרי G6PD:
רוב המאמרים שנמצאו התרכזו ב-Ciprofloxacin, ולכן יפורטו להלן המקרים שאירעו תחת תרופה זו בלבד:
מקרה 1
מאמר שפורסם ב-1999 (Ghanaie and Nassiri) סקר שלושה דיווחי מקרה של גברים בגילאי 28-37 שנטלו Ciprofloxacin במינון 500 מ”ג פעמיים ביום לטיפול בדלקת ריאות עמידה ל-Ampicillin. שלושת המטופלים אושפזו בבית חולים לאחר הופעת צהבת ושתן כהה. ההמוליזה הופיעה 2-4 ימים לאחר נטילת התרופה, ובשניים מתוך השלושה החסר ב-G6PD היה ידוע טרם נטילת התרופה. פעילות האנזים נבחנה במטופלים ונמצא כי שניים מהם בעלי חסר משמעותי, בעוד השלישי בעל חסר חלקי בלבד. כל השלושה שוחררו לאחר התייצבות וירידה בצהבת אחרי 5-7 ימים.
מקרה 2
מכתב לעורך שפורסם ב-1999 (Andrews and Robinson) סקר דיווח מקרה של אישה בת 54 עם מחלת פרקים שגרונית (Rheumatoid arthritis) שהתקבלה לניתוח רביזיה של החלפה מלאה של מפרק הברך. טרם האשפוז רמות המוגלובין ותפקוד כלייתי היו בטווח התקין. שבוע לאחר הניתוח המטופלת פיתחה זיהום בדרכי השתן וזוהה המחולל Escherichia coli; המטופלת קיבלה טיפול ב-Ciprofloxacin במינון 500 מ”ג פעמיים ביום. לאחר יומיים המטופלת פיתחה אוליגוריה ורמת ההמוגלובין ירדה עד 4.4 גרם/דציליטר. במשטח דם נראו Bite cells שאופייניים לאנמיה המוליטית ומבחן Coombs היה שלילי. הטיפול ב-Ciprofloxacin הופסק, ובבדיקת פעילות האנזים G6PD ניכר חסר משמעותי.
מקרה 3
מכתב לעורך שפורסם ב-2010 (Sansone et al.) הציג דיווח מקרה של אישה בת 88 ממוצא סיציליאני שהתייצגה עם בחילות, הקאות ושלשול שבעה ימים לאחר השלמת מחזור טיפול כימותרפי ראשון של Capecitabine ו-Irinotecan לטיפול בסרטן המעי הגס. בהיסטוריה הרפואית היה ידוע על חסר ב-G6PD עם וריאנט ים תיכוני ומספר משברים המוליטיים חריפים בעבר. המשבר ההמוליטי האחרון התרחש כשלוש שנים טרם המקרה, ויוחס לזיהום של שפעת. בעת אבחנת הסרטן פעילות האנזים G6PD נאמדה כנמוכה מהנורמה, ובוצע מבחן Indirect-Coombs שתוצאתו הייתה שלילית.
בקבלתה, רמת ההמוגלובין בדם הייתה 11.1 גרם/דציליטר, והמטופלת קיבלה Metoclopramide ונוזלים. ביום השני המטופלת פיתחה חום סב-פיברילי (37.9 ˚C) ועליה ב-CRP עד 9.14 מ”ג/דציליטר. הוחל טיפול אמפירי ב-Ciprofloxacin תוך-ורידי במינון 500 מ”ג/יום. לאחר המנה השנייה המטופלת פיתחה קוצר נשימה ובימים 3-4 הפכה לציאנוטית. רמת ההמוגלובין ירדה ל-6.4 גרם/דציליטר, ונצפתה עליה ניכרת ב-LDH ובבילירובין בעוד הפטוגלובין היה מתחת לטווח הנורמה. המטופלת קיבלה עירוי מנת דם ונוזלים, האנטיביוטיקה הופסקה והוחלפה ב-Piperacillin/Tazobactam בשל היותה מדוכאת חיסון. המטופלת שוחררה לאחר 30 יום עם המטוקריט של 33.6% והמוגלובין של 11.5 גרם/דציליטר.
מקרה 4
מאמר שפורסם ב-2016 בשפה הספרדית (Lopez et al. תורגם באמצעות מתרגם אינטרנטי חינמי) גולל את סיפורו של מטופל בן 41, צועני עם היסטוריה של אלרגיה לפניצילין. המטופל הגיע למיון עם הדרדרות במצב הכללי ואנוריה, קראטינין היה 12.5 מ”ג/דציליטר, המוגלובין היה בטווח הנורמה. המטופל התאשפז במחלקה האורולוגית בשל חסימה בדרכי השתן, הוחדרו צנתר שתן והוחל טיפול ב-Ciprofloxacin תוך-ורידי במינון 400 מ”ג פעמיים ביום. התפקוד הכלייתי של המטופל השתפר, אך נצפתה צניחה בהמוגלובין שגרמה לחשד לדימום תוך-בטני, אולם הדמיית CT לא איששה את החשד. המטופל נדרש למנות דם, ועדיין ההמוגלובין המשיך לרדת ל-4.6 גרם/דציליטר. רק כאשר הופסק הטיפול ב-Ciprofloxacin וניתנו מנות דם נוספות המטופל התייצב. לאחר שחרור המטופל הופנה לייעוץ המטולוגי, שאבחן אותו עם חסר באנזים G6PD.
הדיווחים הנ”ל מתארים 6 מטופלים שבעקבות טיפול ב-Ciprofloxacin חוו משבר המוליטי, שאופיין בצורה משביעת רצון וכלל אומדן פעילות האנזים G6PD.
סיכום
ההנחיות הקליניות בנוגע לטיפול תרופתי בחולים עם חסר ב-G6PD פורסמו בשנת 2011 על ידי האיגוד הישראלי לרפואת ילדים והאיגוד הישראלי לפרמקולוגיה קלינית וכוללות רק שבע תרופות שזמינות בישראל ונחשבות כאסורות למתן לחולים עם חסר ב-G6PD. בנוסף ההנחיות מציינות מעל 20 תרופות שבעבר נחשבו כאסורות למתן לחולים עם חסר ב-G6PD אולם על פי סקירת הספרות לא צפויה תגובה אליהן בחולים אלו. הסרת האיסור הנ”ל מתרופות בשימוש נרחב כגון Paracetamol, Acetylsalicylic acid, Vitamin C, Dipyrone ועוד היוותה בשורה מבורכת עבור מטפלים ומטופלים – הרחבת אפשרויות טיפול ללא הגדלת סיכון היא תמיד מגמה חיובית.
גם תרופות ממשפחת הפלואורוקווינולונים הוסרו מרשימת התרופות האסורות במצב של חסר ב-G6PD, אולם דיווחים ספורדיים בספרות ואזהרות במאגרי מידע מקובלים כגון Micromedex ו-UpToDate לעיתים מותירים את הקלינאי שנדרש לשאלה זו במצב של היסוס וחוסר ודאות – על אף שמדובר בתופעת לוואי שנחשבת נדירה, אם היא אכן מתרחשת היא עלולה לסכן את המטופל באופן משמעותי (בדומה להארכת מקטע QT ו-Torsades de Pointes על רקע טיפול תרופתי).
בחלוף כ-11 שנים מפרסום ההנחיות הקליניות ועד לעדכונן בפעם הבאה, ישנם מקרים שבהם כדאי לבצע חיפוש נוסף בספרות הרפואית בנוסף לאמור בהנחיות על מנת למסור למטופל/לרופא מידע עדכני ומדוייק ככל שניתן בנוגע להתאמה של תרופות מסויימות לחולים עם חסר ב-G6PD. אין להקל ראש במשמעות הקלינית הנרחבת של צמצום אפשרויות בטיפול אנטיביוטי או של העמסת בדיקות כתנאי נדרש למתן תרופות, הן משיקולים כלכליים והן משיקולי בטיחות והיענות, אולם דיווחי המקרה בספרות רומזים כי ייתכן שבחולים עם חסר ב-G6PD יש מקום להעדיף תרופות אנטיביוטיות אחרות על פני פלואורוקווינולונים כאפשרות ראשונה, במידה ומתאימות למאפייני המחולל והמטופל.
מקורות
Andrews PA, Robinson GT. Intravascular Haemolysis and Interstitial Nephritis in Association with Ciprofloxacin. Nephron. 1999;83(4):359-360. doi:10.1159/000045429
Bhatti, J., Bhatti, G., & Reddy, P. (2017). Mitochondrial dysfunction and oxidative stress in metabolic disorders — A step towards mitochondria based therapeutic strategies. Biochimica Et Biophysica Acta (BBA) – Molecular Basis Of Disease, 1863(5), 1066-1077. doi: 10.1016/j.bbadis.2016.11.010
Brodsky RA. Drug-induced hemolytic anemia. In: UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Accessed on April 8, 2022.)
Bush, N., Diez-Santos, I., Abbott, L., & Maxwell, A. (2020). Quinolones: Mechanism, Lethality and Their Contributions to Antibiotic Resistance. Molecules, 25(23), 5662. doi: 10.3390/molecules25235662
Carmoi T, Bordier L, Bonnefoy S, Callot D, Lecoules S, Algayres J. L ’ ofloxacine est contre-indiquée en cas de déficit en glucose 6 phosphate déshydrogénase (G6PD) : une évidence médicale basée sur les preuves ? Ofloxacin is contraindicated in case of G6PD deficiency : Is it evidenced based ? 2009;30:355-357. doi:10.1016/j.revmed.2008.07.007
Carson, P., Flanagan, C., Ickes, C., & Alving, A. (1956). Enzymatic Deficiency in Primaquine-Sensitive Erythrocytes. Science, 124(3220), 484-485. doi: 10.1126/science.124.3220.484.b
Ghanaie, F., & Nassiri, R. (1999). REPORT OF THREE CASES OF CIPROFLOXACIN-INDUCED HEMOLYTIC ANEMIA IN G6PD DEFICIENT PATIENTS. Medical Journal Of The Islamic Republic Of Iran, 13(2), 157-158. קישור למאמר
Giroflox PRESCRIBING INFORMATION, Ministry of Health of Israel, last update: November 2021.
How to use a G6PD rapid diagnostic test (for detecting glucose-6-phosphate dehydrogenase deficiency): A guide for training at health facility level. Geneva: World Health Organization; 2018 (WHO/CDS/GMP/2018.15). Licence: CC BY-NC-SA 3.0 IGO.
Kurdi-Haidar, B., Mason, P. J., Berrebi, A., Ankra-Badu, G., al-Ali, A., Oppenheim, A., & Luzzatto, L. (1990). Origin and spread of the glucose-6-phosphate dehydrogenase variant (G6PD-Mediterranean) in the Middle East. American journal of human genetics, 47(6), 1013–1019.
López PC, García LL, Ruiz JM, Fernández EM. Anemia hemolítica aguda por Ciprofloxacino. 2016:2014-2016. קישור למאמר
Luzzatto L, Ally M, Notaro R. Glucose-6-phosphate dehydrogenase deficiency. Blood. 2020;136(11):1225-1240. doi:10.1182/BLOOD.2019000944
Morelli, A., Benatti, U., Gaetani, G., & De Flora, A. (1978). Biochemical mechanisms of glucose-6-phosphate dehydrogenase deficiency. Proceedings Of The National Academy Of Sciences, 75(4), 1979-1983. doi: 10.1073/pnas.75.4.1979
Nathan, D., Orkin, S., & Oski, F. (2015). Nathan and Oski’s hematology and oncology of infancy and childhood (8th ed., pp. 609-629). Philadelphia, Pa.: Elsevier.
Nkhoma ET, Poole C, Vannappagari V, Hall SA, Beutler E. The global prevalence of glucose-6-phosphate dehydrogenase deficiency: A systematic review and meta-analysis. Blood Cells, Mol Dis. 2009;42(3):267-278. doi: 10.1016/j.bcmd.2008.12.005
Pizzino, G., Irrera, N., Cucinotta, M., Pallio, G., Mannino, F., & Arcoraci, V. et al. (2017). Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine And Cellular Longevity, 2017, 1-13. doi: 10.1155/2017/8416763
Rosselli, M. (1998). Role of nitric oxide in the biology, physiology and pathophysiology of reproduction. Human Reproduction Update, 4(1), 3-24. doi: 10.1093/humupd/4.1.3
Salehifar, E., Aliyali, M., & Bazi, A. (2021). Acute Hemolytic Anemia Induced by Levofloxacin in A Woman With G6PD Deficiency: A Case Report. Case Reports In Clinical Practice. doi: 10.18502/crcp.v6i4.7854
Sansone S, Rottensteiner J, Stocker J, Rosanelli C, Wiedermann CJ. Ciprofloxacin-induced acute haemolytic anaemia in a patient with glucose-6-phosphate dehydrogenase Mediterranean deficiency: a case report. Ann Hematol. 2010;89(9):935-937. doi:10.1007/S00277-010-0903-7
Sansone, G., & Segni, G. (1958). Nuovi aspetti dell’alterato biochimismo degli eritrociti di favici: assenza pressochè completa della glucoso-6-P deldrogenasi [New aspects of the biochemical alterations in the erythrocytes of patients with favism; almost complete absence of glucose-6-phosphate dehydrogenase]. Bollettino della Societa italiana di biologia sperimentale, 34(7), 327–329. קישור
Singh, A., Kukreti, R., Saso, L., & Kukreti, S. (2019). Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules, 24(8), 1583. doi: 10.3390/molecules24081583
Smith, T., Kirkpatrick, D., Smith, S., Smith, T., Pearson, T., & Kailasam, A. et al. (2017). Radioprotective agents to prevent cellular damage due to ionizing radiation. Journal Of Translational Medicine, 15(1). doi: 10.1186/s12967-017-1338-x
Tripathi, P., Agarwal, S., & Muthuswamy, S. (2019). Prevalence and Genetic Characterization of Glucose-6-Phosphate Dehydrogenase Deficiency in Anemic Subjects from Uttar Pradesh, India. Journal Of Pediatric Genetics, 08(02), 047-053. doi: 10.1055/s-0039-1677729
Youngster I, Arcavi L, Schechmaster R, et al. Medications and glucose-6-phosphate dehydrogenase deficiency: an evidence-based review. Drug Saf. 2010;33(9):713-726. doi:10.2165/11536520-000000000-00000
Zaidman JL, Leiba H, Scharf S, Steinman I. Red cell glucose-6-phosphate dehydrogenase deficiency in ethnic groups in Israel. Clin Genet. 1976;9(2):131-133. doi:10.1111/J.1399-0004.1976.TB01558.X4.
ההסתדרות הרפואית בישראל | טיפול תרופתי באנשים חסרי האנזים G6PD. https://www.ima.org.il/userfiles/image/clinical_20_enzim.pdf, Accessed April 8, 2022.
MedicinesComplete — CONTENT > BNF > Treatment summary: Anaemias. https://www-medicinescomplete-com.assutaashdod-ez.medlcp.tau.ac.il/#/content/bnf/_254362529?hspl=g6pd#content%2Fbnf%2F_254362529%23section_254362529-2. Accessed April 8, 2022.
